Combinação de medicamentos casirivimabe e imdevimabe reduziu internações e mortes em pacientes ambulatoriais sintomáticos

A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou o uso emergencial do coquetel de medicamentos casirivimabe e imdevimabe para o tratamento da Covid-19, doença causada pelo novo coronavírus.
A liberação ocorreu nesta terça-feira (20/4), após reunião da diretoria colegiada da agência. Os remédios são produzidos pela empresa Produtos Roche Químicos e Farmacêuticos. A documentação com o pedido foi entregue no começo do mês.
Segundo a Anvisa, o uso de medicamentos será restrito a hospitais e poderá ser usado em pacientes acima de 12 anos que possuam mais de 40 kg.
Os estudos mostram que o uso do coquetel reduziu em 70,4% o tempo de internações e de mortes em pacientes que ambulatoriais sintomáticos. Segundo o laboratório, a medicação funcionaria como um coquetel de anticorpos.
“O uso reduziu a carga viral, o que é uma achado importante. O perfil de segurança também foi bem aceitado”, explica Gustavo Mendes, gerente da Gerência Geral de Medicamentos e Produtos Biológicos da Anvisa.
O medicamento foi autorizado para uso emergencial pela Food and Drug Administration (FDA), agência reguladora dos Estados Unidos, após apresentar resultados satisfatórios em pacientes com sintomas leves e moderados da covid-19. O mesmo ocorreu em países europeus.
Anticorpos
A combinação dos casirivimabe e imdevimabe, chamados de anticorpos monoclonais, são usados para tratar câncer e doenças autoimunes, e são criados a partir de uma única célula e clonados em laboratório.
Eles são baseados nos anticorpos criados naturalmente pelo sistema imunológico do corpo, embora sejam frequentemente modificados para uma maior eficácia e segurança.
A agência considerou que, devido ao momento atual da pandemia e a qualidade da documentação do pedido, sustentam a liberação do uso. Contudo, a farmacêutica deverá abastecer a Anvisa com novos relatórios para ancorar a decisão.
A diretora da Anvisa, Meiruze Freitas, destacou que a liberação do coquetel durante a emergência em saúde é uma forma de aumentar a possibilidade de tratamento.
“Os pareceres técnicos são emitidos por equipes multidisciplinares e por servidores capacidades da Anvisa”, destacou ao defender os critérios de eficácia e segurança dos remédios.
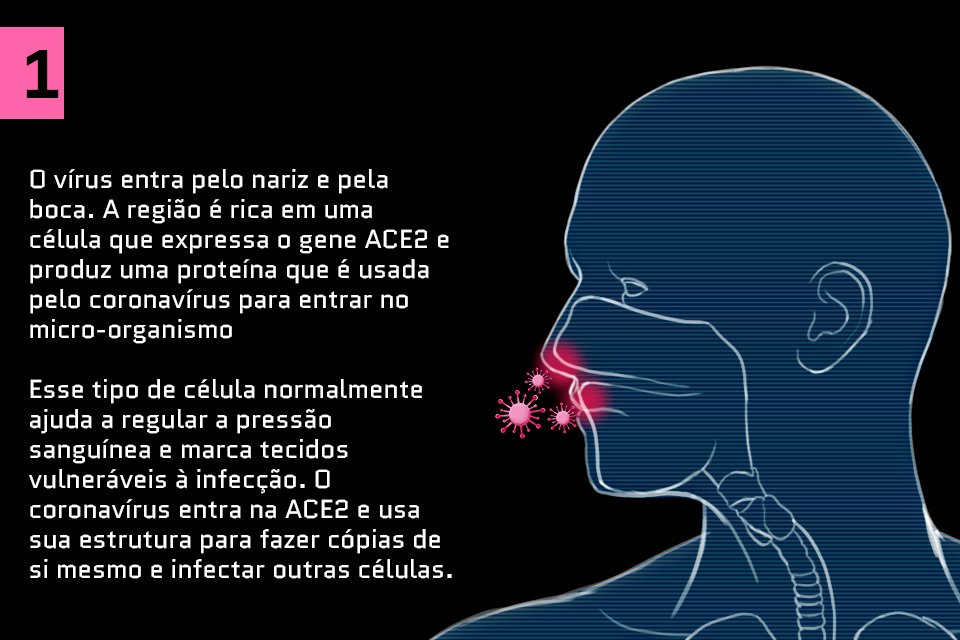
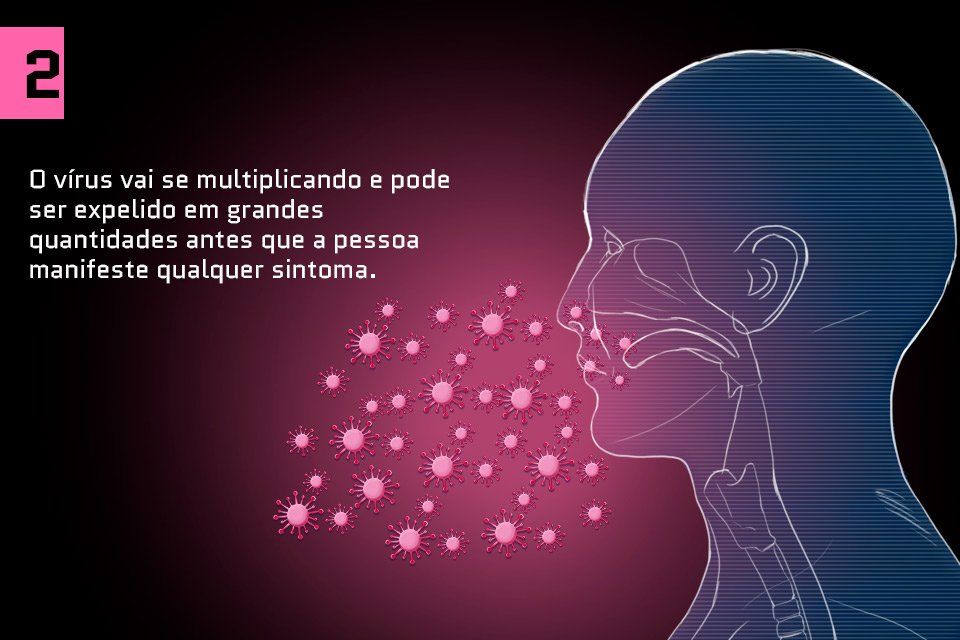
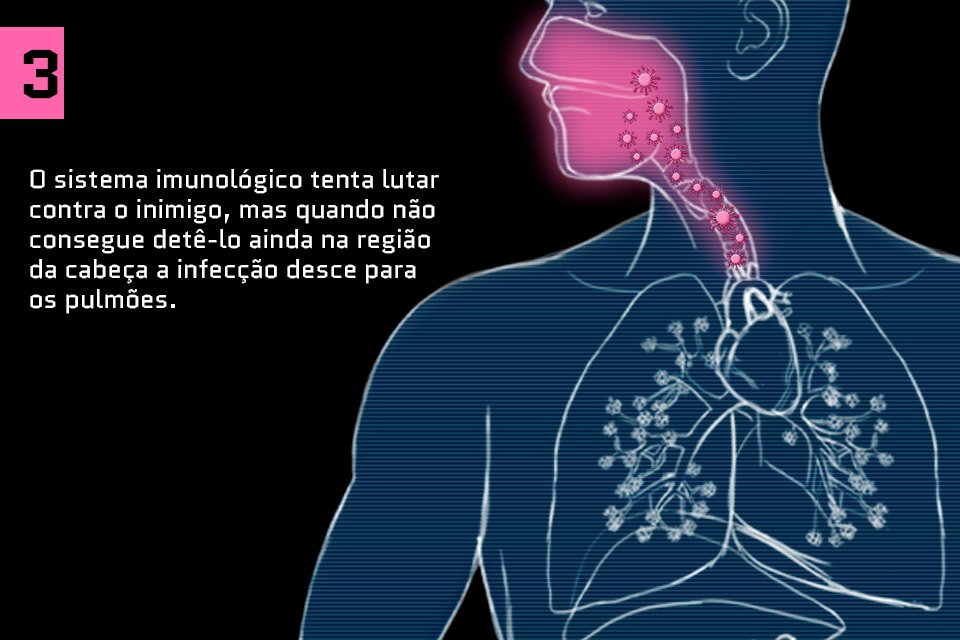
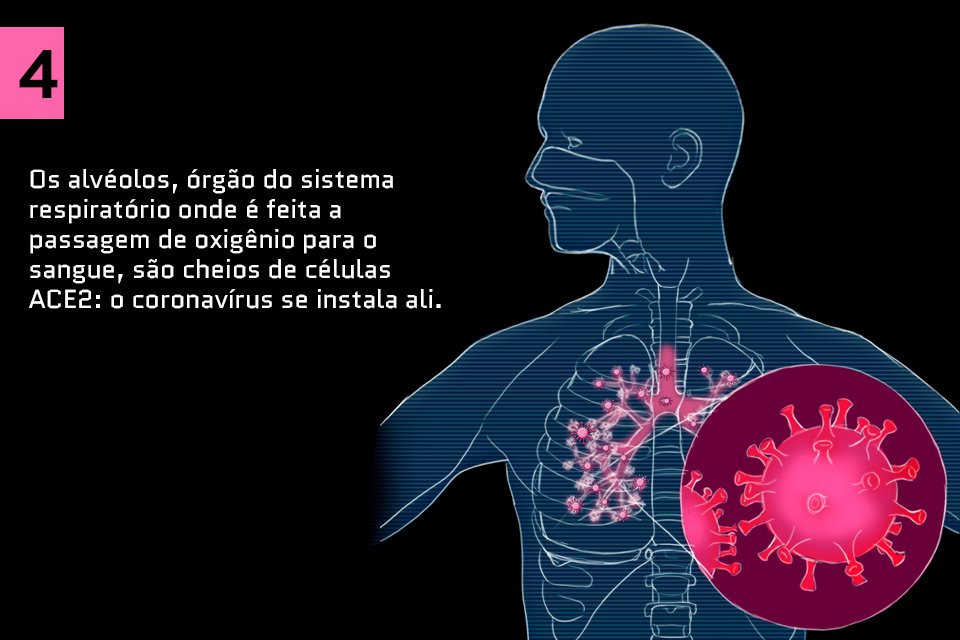
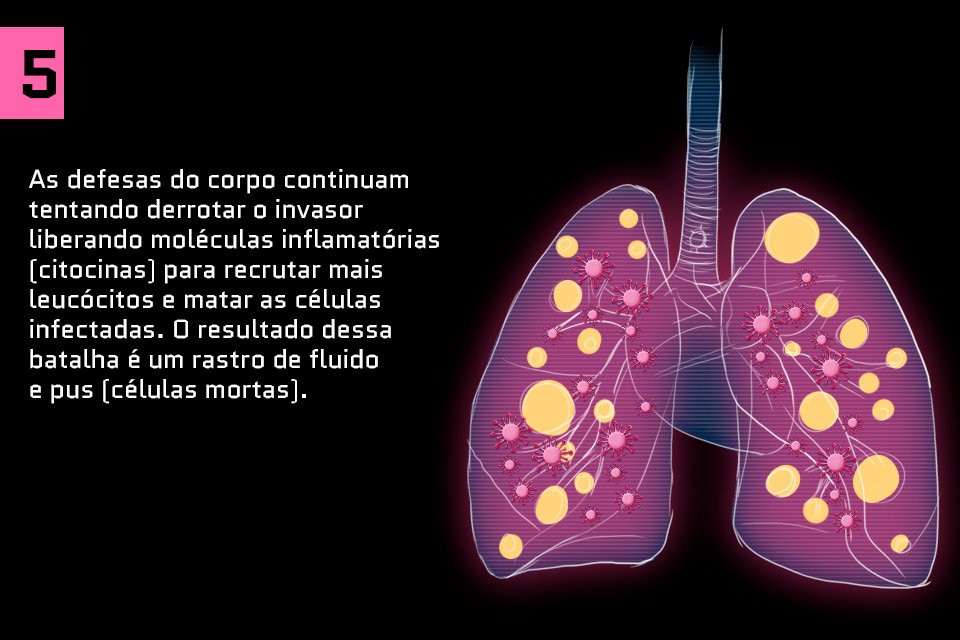
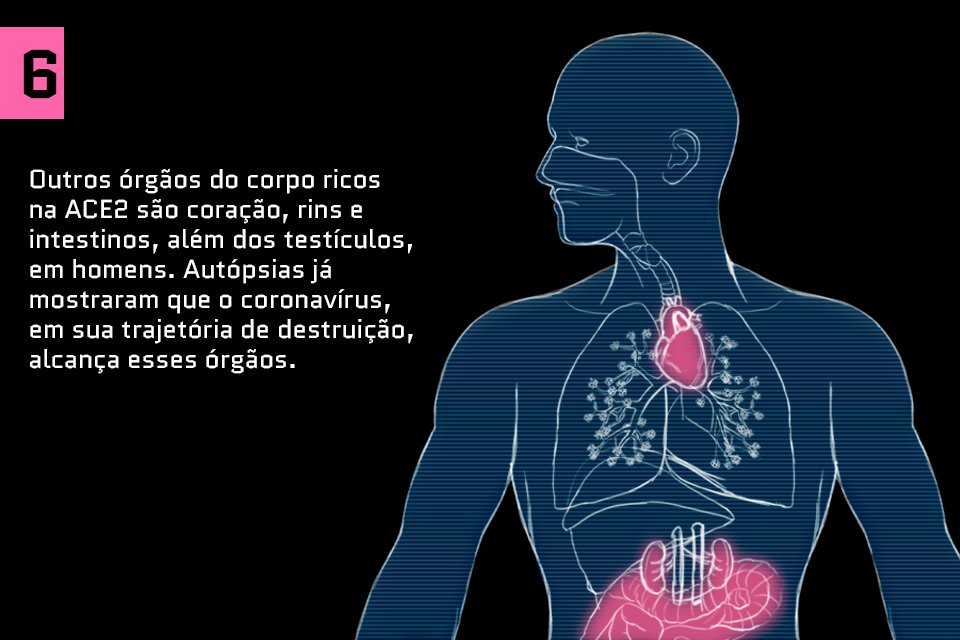
Saiba como o coronavírus ataca o corpo humano:
Liberado
Em 12 de março, a Anvisa liberou Rendesivir para tratar Covid. O antiviral foi o primeiro medicamento aprovado para uso em pacientes hospitalizados. Ele não é vendido em farmácias.
Com o registro, o Rendesenvir é administrado via injetável e exclusivamente em hospitais. A medida é para que o paciente seja monitorado. Segundo a Anvisa, o remédio não cura, mas reduz o tempo de internação de pacientes. (Metrópoles)